คำตอบที่ได้รับเลือกจากเจ้าของกระทู้
ความคิดเห็นที่ 15
Phase หรือ สถานะของสสาร หลักๆมีด้วยกัน 3 สถานะอย่างที่เราๆรู้ๆกันอยู่ อันได้แก่
1. Solid (ของแข็ง)
2. Liquid (ของเหลว)
3. Gas (ก๊าซ)
แต่ปัจจุบันองค์ความรู้และเทคโนโลยีได้ทำให้เราได้ค้นพบว่า Phase ไม่ได้มีเพียงแค่ 3 สถานะเท่านั้น
อย่างเช่น Plasma และ Supercritical Fluid หรืออื่นๆอีกมากมายที่ยังไม่ได้กล่าวมา โดยขึ้นอยู่กับองค์ความรู้ทางสาขาวิชาเคมี ฟิสิกส์
จะจัดแบ่งแยกประเภทเพิ่มเติม
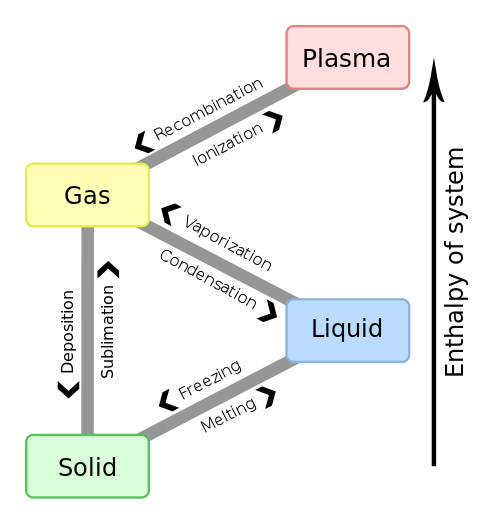
จากภาพแสดงถึงการเปลี่ยนแปลงสถานะของสสาร อย่างเช่น
Melting point (จุดหลอมเหลว) คือ จุดที่สารเปลี่ยนสถานะจากของแข็งเป็นของเหลว
Melting
Solid ============> Liquid
Freezing point (จุดเยือกแข็ง) คือ จุดที่สารเปลี่ยนสถานะจากของเหลวเป็นของแข็ง
Freezing
Liquid <============= Solid
***ในทางทฤษฎีจุดทั้งสองคือจุดเดียวกันแต่มีทิศทางในการเปลี่ยนสถานะของสสารคนละทิศทางกันเท่านั้นเอง***
แล้วอะไรคือปัจจัยที่ทำให้เกิดการเปลี่ยนสถานะของสสาร ??
ปัจจัยที่มีผลต่อการเปลี่ยนแปลงสถานะของสสารก็คือ
1. Temperature (อุณหภูมิ)
2. Pressure (ความดัน)
ดังจะเห็นได้จากกราฟแสดงการเปลี่ยนสถานะของสสารที่เรียกว่า Phase Diagram หรือ แผนผังวัฏภาค
ส่วนจุดที่แสดงถึงภาวะสมดุลทั้ง 3 สถานะ เรียกว่า Triple point หรือ จุดร่วมสาม
***สสารต่างชนิดกันก็จะมี Phase Diagram ที่แตกต่างกันไปด้วย***
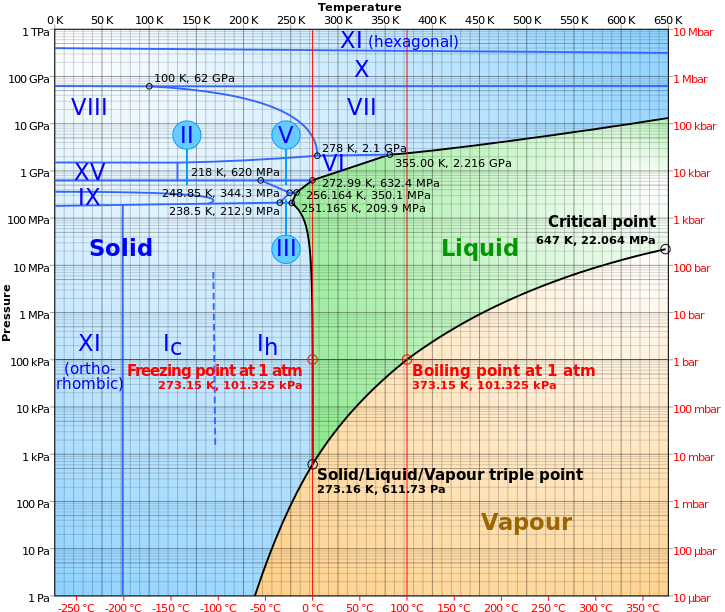
จากภาพแสดงถึง Phase Diagram ของน้ำ (H2O)
ณ ที่ๆมี อุณหภูมิ 273.15 K (0 ํC) ความดันบรรยากาศ 101.325 kPa (1 atm) >> ที่สภาวะนี้เรียกอีกอย่างว่า STP [Spoil] คลิกเพื่อดูข้อความที่ซ่อนไว้ (อย่างคราวๆ)
น้ำจะเริ่มเปลี่ยสถานะ Solid <====> Liquid
ณ ที่ๆมี อุณหภูมิ 373.15 K (100 ํC) ความดันบรรยากาศ 101.325 kPa (1 atm)
น้ำจะเริ่มเปลี่ยสถานะ Liquid <====> Gas
แต่ถ้า ณ ที่แห่งนั้นมีความดันบรรยากาศเพียง 100 Pa น้ำจะไม่ผ่านสถานะของเหลว
น้ำจะมีพฤติกรรมคล้ายกับลูกเหม็นหรือก้อนน้ำแข็งแห้ง CO2(s) กล่าวคือ
จากก้อนน้ำแข็ง H2O(s) จะสามารถเปลี่ยนสถานะไปเป็นไอน้ำ H2O(g) ได้ทันที
โดยไม่ต้องผ่านสถานะของเหลว H2O(l) ก่อน อย่างในสภาวะปกติที่เราคุ้นเคยกันดี
จากความรู้ข้างต้นนี้ส่วนตัวคิดว่าน่าจะสามารถตอบคำถามข้างต้นได้แล้วว่า ไม่มีสารใดที่มีจุดหลอมเหลวสูงกว่าจุดเดือด
เหตุผลคือ คนส่วนใหญ่มักเข้าใจผิดกันว่าการเดือด (Boiling) คือการเปลี่ยนสถานะสสารเป็นไอ เพราะฉะนั้นถ้าของแข็งเปลี่ยนสถานะเป็นไอ
ก็น่าจะเรียกว่าเกิดการเดือดขึ้นได้ โดยที่มีจุดเดือด (ฺBoiling Point) เท่านั้นเท่านี้
ซึ่งแท้ที่จริงแล้วหากเรากลับไปดูภาพ Phase Transition ในรูปแรกจะพบว่า การเดือด (Boiling) ต้องมีสถานะเปลี่ยนผ่านจาก ของเหลว >>> ไอ
จากนิยามที่ว่า [Spoil] คลิกเพื่อดูข้อความที่ซ่อนไว้
ดังนั้น ของแข็งที่เปลี่ยนสถานะไปเป็นไอ จะเรียกว่า Sublimation หรือ การระเหิด (ต่างจากการระเหยนะคะ อย่าสับสนกัน) [Spoil] คลิกเพื่อดูข้อความที่ซ่อนไว้ จากการที่ลองค้นหาข้อมูลดูแล้ว เว็บไซต์ส่วนใหญ่เค้ามักจะไม่ค่อยเรียกว่า Sublimation point / Sublimating point (จุดระเหิด) กันซักเท่าไหร่ (แปลกดี) ส่วนใหญ่ก็จะเรียกว่า Boiling point กันแล้วก็จะโน้ตไว้ข้างใต้ว่า "Boiling Point: Arsenic sublimates at this temperature." ยังดีหน่อยที่ wikipedia ใช้คำว่า Sublimation point ซึ่งเป็นความเข้าใจที่ถูกต้อง
ภาพประกอบความเข้าใจ

ที่สภาวะ P2 สสารนั้นจะมี Melting point ที่สูงกว่า Boiling point ที่สภาวะ P1 นั่นเอง (อันนี้อธิบายตามความเข้าใจผิดที่ว่าสภาวะที่มีการระเหิด คือ Boiling point)
จะยกตัวอย่างธาตุๆนึงคือ Arsenic (As) ที่สภาวะปกติมีสถานะเป็นของแข็ง ลองดูรูปนี้นะคะ


ถ้าตามความเข้าใจแบบผิดๆเหมือนข้างต้นที่กล่าวมา จากรูปก็จะบอกได้ว่า As มีจุดหลอมเหลวมากกว่าจุดเดือด อย่างที่น้องเข้าพูดกับคุณ
จขกท. ค่ะ น้องอาจจะรับรู้มาแบบผิดๆจากในสารคดี โดยความเห็นส่วนตัวขอเดาว่า สารคดีที่น้องเค้าดูอาจจะแปลมาจากสารคดีของต่างประเทศ ซึ่งสารคดีต่างประเทศน่าจะใช้คำว่า Boiling point คนแปลก็คงแปลไปตามนั้นไม่ได้คิดว่า Boiling point ในที่นี้น่าจะคือสภาวะที่เกิดการระเหิด จริงๆแล้วควรพูดว่า Sublimation point หรือ จุดระเหิด มากกว่า
หากผิดพลาดประการใด ขออภัยล่วงหน้าค่ะ
***เพิ่มเติมนะคะ การที่เราจะพูดถึงจุดเดือดหรือจุดหลอมเหลวอะไรอย่างนี้ ถ้าจะให้ดีและเข้าใจตรงกัน ควรจะบอกอุณหูมิ และ ความดัน ณ สภาวะนั้นๆ ค่ะ
References
1. http://en.wikipedia.org/wiki/Phase_transition
2. http://en.wikipedia.org/wiki/Boiling_point
3. http://en.wikipedia.org/wiki/Sublimation_%28phase_transition%29
4. http://en.wikipedia.org/wiki/Standard_conditions_for_temperature_and_pressure
5. http://www.il.mahidol.ac.th/e-media/ap-chemistry2/liquid_solution/liquid_phase_diagram.htm
1. Solid (ของแข็ง)
2. Liquid (ของเหลว)
3. Gas (ก๊าซ)
แต่ปัจจุบันองค์ความรู้และเทคโนโลยีได้ทำให้เราได้ค้นพบว่า Phase ไม่ได้มีเพียงแค่ 3 สถานะเท่านั้น
อย่างเช่น Plasma และ Supercritical Fluid หรืออื่นๆอีกมากมายที่ยังไม่ได้กล่าวมา โดยขึ้นอยู่กับองค์ความรู้ทางสาขาวิชาเคมี ฟิสิกส์
จะจัดแบ่งแยกประเภทเพิ่มเติม

http://en.wikipedia.org/wiki/Phase_transition#mediaviewer/File:Phase_change_-_en.svg
จากภาพแสดงถึงการเปลี่ยนแปลงสถานะของสสาร อย่างเช่น
Melting point (จุดหลอมเหลว) คือ จุดที่สารเปลี่ยนสถานะจากของแข็งเป็นของเหลว
Melting
Solid ============> Liquid
Freezing point (จุดเยือกแข็ง) คือ จุดที่สารเปลี่ยนสถานะจากของเหลวเป็นของแข็ง
Freezing
Liquid <============= Solid
***ในทางทฤษฎีจุดทั้งสองคือจุดเดียวกันแต่มีทิศทางในการเปลี่ยนสถานะของสสารคนละทิศทางกันเท่านั้นเอง***
แล้วอะไรคือปัจจัยที่ทำให้เกิดการเปลี่ยนสถานะของสสาร ??
ปัจจัยที่มีผลต่อการเปลี่ยนแปลงสถานะของสสารก็คือ
1. Temperature (อุณหภูมิ)
2. Pressure (ความดัน)
ดังจะเห็นได้จากกราฟแสดงการเปลี่ยนสถานะของสสารที่เรียกว่า Phase Diagram หรือ แผนผังวัฏภาค
ส่วนจุดที่แสดงถึงภาวะสมดุลทั้ง 3 สถานะ เรียกว่า Triple point หรือ จุดร่วมสาม
***สสารต่างชนิดกันก็จะมี Phase Diagram ที่แตกต่างกันไปด้วย***

http://en.wikipedia.org/wiki/Triple_point#mediaviewer/File:Phase_diagram_of_water.svg
จากภาพแสดงถึง Phase Diagram ของน้ำ (H2O)
ณ ที่ๆมี อุณหภูมิ 273.15 K (0 ํC) ความดันบรรยากาศ 101.325 kPa (1 atm) >> ที่สภาวะนี้เรียกอีกอย่างว่า STP [Spoil] คลิกเพื่อดูข้อความที่ซ่อนไว้ (อย่างคราวๆ)
น้ำจะเริ่มเปลี่ยสถานะ Solid <====> Liquid
ณ ที่ๆมี อุณหภูมิ 373.15 K (100 ํC) ความดันบรรยากาศ 101.325 kPa (1 atm)
น้ำจะเริ่มเปลี่ยสถานะ Liquid <====> Gas
แต่ถ้า ณ ที่แห่งนั้นมีความดันบรรยากาศเพียง 100 Pa น้ำจะไม่ผ่านสถานะของเหลว
น้ำจะมีพฤติกรรมคล้ายกับลูกเหม็นหรือก้อนน้ำแข็งแห้ง CO2(s) กล่าวคือ
จากก้อนน้ำแข็ง H2O(s) จะสามารถเปลี่ยนสถานะไปเป็นไอน้ำ H2O(g) ได้ทันที
โดยไม่ต้องผ่านสถานะของเหลว H2O(l) ก่อน อย่างในสภาวะปกติที่เราคุ้นเคยกันดี
จากความรู้ข้างต้นนี้ส่วนตัวคิดว่าน่าจะสามารถตอบคำถามข้างต้นได้แล้วว่า ไม่มีสารใดที่มีจุดหลอมเหลวสูงกว่าจุดเดือด
เหตุผลคือ คนส่วนใหญ่มักเข้าใจผิดกันว่าการเดือด (Boiling) คือการเปลี่ยนสถานะสสารเป็นไอ เพราะฉะนั้นถ้าของแข็งเปลี่ยนสถานะเป็นไอ
ก็น่าจะเรียกว่าเกิดการเดือดขึ้นได้ โดยที่มีจุดเดือด (ฺBoiling Point) เท่านั้นเท่านี้
ซึ่งแท้ที่จริงแล้วหากเรากลับไปดูภาพ Phase Transition ในรูปแรกจะพบว่า การเดือด (Boiling) ต้องมีสถานะเปลี่ยนผ่านจาก ของเหลว >>> ไอ
จากนิยามที่ว่า [Spoil] คลิกเพื่อดูข้อความที่ซ่อนไว้
ดังนั้น ของแข็งที่เปลี่ยนสถานะไปเป็นไอ จะเรียกว่า Sublimation หรือ การระเหิด (ต่างจากการระเหยนะคะ อย่าสับสนกัน) [Spoil] คลิกเพื่อดูข้อความที่ซ่อนไว้ จากการที่ลองค้นหาข้อมูลดูแล้ว เว็บไซต์ส่วนใหญ่เค้ามักจะไม่ค่อยเรียกว่า Sublimation point / Sublimating point (จุดระเหิด) กันซักเท่าไหร่ (แปลกดี) ส่วนใหญ่ก็จะเรียกว่า Boiling point กันแล้วก็จะโน้ตไว้ข้างใต้ว่า "Boiling Point: Arsenic sublimates at this temperature." ยังดีหน่อยที่ wikipedia ใช้คำว่า Sublimation point ซึ่งเป็นความเข้าใจที่ถูกต้อง
ภาพประกอบความเข้าใจ

Original figure from http://ilovecharts.tumblr.com/post/57431210108/invaderxan-phase-diagram-for-water-the-triple
ที่สภาวะ P2 สสารนั้นจะมี Melting point ที่สูงกว่า Boiling point ที่สภาวะ P1 นั่นเอง (อันนี้อธิบายตามความเข้าใจผิดที่ว่าสภาวะที่มีการระเหิด คือ Boiling point)
จะยกตัวอย่างธาตุๆนึงคือ Arsenic (As) ที่สภาวะปกติมีสถานะเป็นของแข็ง ลองดูรูปนี้นะคะ


http://periodictable.com/Elements/033/data.html
ถ้าตามความเข้าใจแบบผิดๆเหมือนข้างต้นที่กล่าวมา จากรูปก็จะบอกได้ว่า As มีจุดหลอมเหลวมากกว่าจุดเดือด อย่างที่น้องเข้าพูดกับคุณ
จขกท. ค่ะ น้องอาจจะรับรู้มาแบบผิดๆจากในสารคดี โดยความเห็นส่วนตัวขอเดาว่า สารคดีที่น้องเค้าดูอาจจะแปลมาจากสารคดีของต่างประเทศ ซึ่งสารคดีต่างประเทศน่าจะใช้คำว่า Boiling point คนแปลก็คงแปลไปตามนั้นไม่ได้คิดว่า Boiling point ในที่นี้น่าจะคือสภาวะที่เกิดการระเหิด จริงๆแล้วควรพูดว่า Sublimation point หรือ จุดระเหิด มากกว่า
หากผิดพลาดประการใด ขออภัยล่วงหน้าค่ะ
***เพิ่มเติมนะคะ การที่เราจะพูดถึงจุดเดือดหรือจุดหลอมเหลวอะไรอย่างนี้ ถ้าจะให้ดีและเข้าใจตรงกัน ควรจะบอกอุณหูมิ และ ความดัน ณ สภาวะนั้นๆ ค่ะ
References
1. http://en.wikipedia.org/wiki/Phase_transition
2. http://en.wikipedia.org/wiki/Boiling_point
3. http://en.wikipedia.org/wiki/Sublimation_%28phase_transition%29
4. http://en.wikipedia.org/wiki/Standard_conditions_for_temperature_and_pressure
5. http://www.il.mahidol.ac.th/e-media/ap-chemistry2/liquid_solution/liquid_phase_diagram.htm
แสดงความคิดเห็น



ตอบลูกชายไม่ได้ครับ...
พ่อๆ มีธาตุที่ จุดหลอมเหลวใช้อุณหภูมิสูงกว่าจุดเดือดด้วยหรือครับ ..!!??
เป็นไปได้ยังไง อธิบายให้ฟังมั่ง....!!
ก็ได้แต่ตอบลูกชายไปว่า.." อืมม เดี๋ยวพ่อถามพันทิปให้ดูนะ."
ปล.คือเค้าเข้าใจว่า มันต้องถึงจุดหลอมเหลวก่อนสิ ถึงค่อยถึงจุดเดือด..!!
รบกวนหน่อยนะครับ ...จะได้ให้เขามาอ่าน เขาเป็นคนชอบอะไรเกี่ยวกับวิทยาศาสตร์