คำตอบที่ได้รับเลือกจากเจ้าของกระทู้
ความคิดเห็นที่ 2
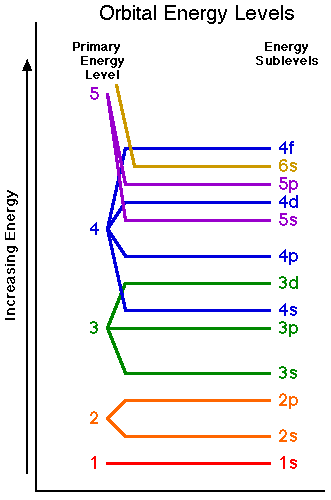
ใช่แล้วครับเราถูกสอนให้เติม e- จากพลังงานต่ำไปสูง แล้วเวลาดึง ก็ต้องดึงจากชั้นนอกไปชั้นใน หรืออีกนัยหนึ่งคือ ดึงจาก e- ที่มีพลังงานสูงก่อน <-- ประโยคนี้ขัดแย้งกันเอง สำหรับ 3d และ 4s orbital แบบที่น้องถามเลย
จากรูปที่แปะ แผนภาพนี้ใช้ได้ดีกับธาตุ 20 ตัวแรกเท่านั้นครับ หลังจาก 21 เป็นต้นไป แรงดูดและแรงผลักของอนุภาคมูลฐาน รวมไปถึงรูปร่างของ orbital และการ shielding ของ e- ชั้นใน ส่งผลให้แผนภาพต่างออกไป นั่นทำให้ เกิดข้อยกเว้นในการจัดเรียงมากมายเกิดขึ้นในธาตุลำดับหลังๆ ตัวอย่างเช่น transition metal Sc-Zn (Z = 21-30) นั้น จริงๆแล้ว 3d มีพลังงานที่ต่ำกว่า 4s แปลว่าเจ้าแผนภาพที่ใช้มาตลอด ใช้ไม่ได้ นั่นเองครับ
อย่างไรก็ตาม ถ้าเป็นแบบนั้น แล้วทำไม Sc ถึงไม่จัดเป็น [Ar] 3d3 เสียล่ะ ทำไมถึงเป็น [Ar] 3d1 4s2 ???
ปรากฎว่า ถ้าเราลองมองย้อนกลับ Sc3+ ที่จัดเหมือน [Ar] นั้นพอเกิดเป็น Sc2+ [Ar] 3d1 ใช่ไหมครับ แต่พอเราเติม e- เข้าไปอีกตัว Sc+ จัดเป็น [Ar] 3d1 4s2 ซะงั้น อันนี้ต้องพิจารณาจาก gap ของ
3d vs 4s ว่าเติมที่ orbital ไหนแล้วเกิดแรงผลักน้อยกว่า e- ก็จะมีความเสถียรมากกว่านั่นเองครับ เนื่องจากตัว 3d orbital มีขนาดเล็กะทัดรัด และอยู่ใกล้นิวเคลียสมากกว่า เลยกระโดดไปเติมใน 4s จะมีแรงผลักน้อยกว่านั่นเองครับ ทั้งนี้พอเป็น transition metal ตัวอื่น gap ระหว่าง 3d และ 4s ก็เปลี่ยนไป ทำให้ต้องพิจารณาเป็นตัวๆไปครับ
ทีนี้ถ้ามองภาพให้ง่าย ตามคำถามของน้อง ก็คือ เมื่อ 3d ถูกเติม e- ลงไป พลังงานของมันจะต่ำลงครับ และต่ำลงกว่า 4s orbital รวมไปถึง e- ใน 3d orbital จะ shielding e- ใน 4s orbital ทำให้แรงดึงดูดระหว่างนิวเคลียส และ 4s e- น้อยลงครับ จึงเป็นเหตุผลให้ดึง 4s ก่อน 3d แต่เติม 4s ก่อน 3d
Ref
https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Electronic_Structure_of_Atoms_and_Molecules/Electronic_Configurations/The_Order_of_Filling_3d_and_4s_Orbitals

ใช่แล้วครับเราถูกสอนให้เติม e- จากพลังงานต่ำไปสูง แล้วเวลาดึง ก็ต้องดึงจากชั้นนอกไปชั้นใน หรืออีกนัยหนึ่งคือ ดึงจาก e- ที่มีพลังงานสูงก่อน <-- ประโยคนี้ขัดแย้งกันเอง สำหรับ 3d และ 4s orbital แบบที่น้องถามเลย
จากรูปที่แปะ แผนภาพนี้ใช้ได้ดีกับธาตุ 20 ตัวแรกเท่านั้นครับ หลังจาก 21 เป็นต้นไป แรงดูดและแรงผลักของอนุภาคมูลฐาน รวมไปถึงรูปร่างของ orbital และการ shielding ของ e- ชั้นใน ส่งผลให้แผนภาพต่างออกไป นั่นทำให้ เกิดข้อยกเว้นในการจัดเรียงมากมายเกิดขึ้นในธาตุลำดับหลังๆ ตัวอย่างเช่น transition metal Sc-Zn (Z = 21-30) นั้น จริงๆแล้ว 3d มีพลังงานที่ต่ำกว่า 4s แปลว่าเจ้าแผนภาพที่ใช้มาตลอด ใช้ไม่ได้ นั่นเองครับ
อย่างไรก็ตาม ถ้าเป็นแบบนั้น แล้วทำไม Sc ถึงไม่จัดเป็น [Ar] 3d3 เสียล่ะ ทำไมถึงเป็น [Ar] 3d1 4s2 ???
ปรากฎว่า ถ้าเราลองมองย้อนกลับ Sc3+ ที่จัดเหมือน [Ar] นั้นพอเกิดเป็น Sc2+ [Ar] 3d1 ใช่ไหมครับ แต่พอเราเติม e- เข้าไปอีกตัว Sc+ จัดเป็น [Ar] 3d1 4s2 ซะงั้น อันนี้ต้องพิจารณาจาก gap ของ
3d vs 4s ว่าเติมที่ orbital ไหนแล้วเกิดแรงผลักน้อยกว่า e- ก็จะมีความเสถียรมากกว่านั่นเองครับ เนื่องจากตัว 3d orbital มีขนาดเล็กะทัดรัด และอยู่ใกล้นิวเคลียสมากกว่า เลยกระโดดไปเติมใน 4s จะมีแรงผลักน้อยกว่านั่นเองครับ ทั้งนี้พอเป็น transition metal ตัวอื่น gap ระหว่าง 3d และ 4s ก็เปลี่ยนไป ทำให้ต้องพิจารณาเป็นตัวๆไปครับ
ทีนี้ถ้ามองภาพให้ง่าย ตามคำถามของน้อง ก็คือ เมื่อ 3d ถูกเติม e- ลงไป พลังงานของมันจะต่ำลงครับ และต่ำลงกว่า 4s orbital รวมไปถึง e- ใน 3d orbital จะ shielding e- ใน 4s orbital ทำให้แรงดึงดูดระหว่างนิวเคลียส และ 4s e- น้อยลงครับ จึงเป็นเหตุผลให้ดึง 4s ก่อน 3d แต่เติม 4s ก่อน 3d
Ref
https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Electronic_Structure_of_Atoms_and_Molecules/Electronic_Configurations/The_Order_of_Filling_3d_and_4s_Orbitals
แสดงความคิดเห็น



เคมีการจัดเรียงอิเล็กตรอนแบบย่อย